Алгоритм болей в спине

В статье проведено обобщение современных подходов к диагностике и лечению синдрома боли в спине на уровне амбулаторной терапевтической службы. Приведены алгоритмы стандартных и минимально необходимых диагностических манипуляций, очерчены показания для назначения консультаций смежных специалистов.
Введение
Синдром боли в спине остается одной из самых частых причин обращения к врачу как в нашей стране, так и за рубежом [1, 2]. Согласно последним эпидемиологическим исследованиям, в течение жизни боль в спине возникает у 70–90% населения, преимущественно у людей трудоспособного возраста, а у 20–25% регистрируется ежегодно [3]. Глобальное исследование заболеваемости населения (Global Burden of Disease Study) признало боль в спине главной причиной нетрудоспособности в мире [4]. Боль в нижней части спины (БНС) является одной из самых частых причин обращения к врачам самых разных специальностей. Европейское многоцентровое исследование продемонстрировало, что хронической болью страдает более 20% жителей Европы, при этом большинство пациентов испытывало боль именно в нижней части спины [5].
При этом на терапевтическое звено оказания медицинской помощи падает наибольшая нагрузка по работе с данной категорией пациентов. Согласно опросу, проведенному Всероссийским центром изучения общественного мнения (ВЦИОМ) в ноябре 2017 г., охватившему более 700 жителей РФ трудоспособного возраста (от 22 до 45 лет), испытывавших боли в спине в настоящее время или в течение последнего года, выявлено, что более 1/3 из них обращались именно к терапевту с жалобами на боли в спине (рис. 1).
Диагностический поиск при БНС
Очевидно, что боль как патологический феномен является целой цепью изменений на разных уровнях организма [2]. Поначалу защитный механизм, сигнализирующий о проблеме, позднее становится серьезным и, подчас, самостоятельным страданием. Как писал еще Авиценна: «Боль помогает врачу распознать заболевание, нередко указывая правильный путь лечения. Такая боль приносит пользу, подобно огню, когда он согревает, а не сжигает; подобно воде, когда она орошает, а не затопляет, подобно ветру, когда он освежает, а не разрушает».
Поэтому задачи терапевтической службы — не столько постановка точного топического диагноза, сколько скрининг и анализ основных жалоб и симптомов, исключение серьезной патологии (так называемых «красных флагов»), назначение противоболевой терапии, которая сама по себе может дать подсказки о причине развития болевого синдрома, и при необходимости направление пациента к узкому специалисту для уточнения диагноза [1, 3].
БНС характеризуют как боль, мышечное напряжение и/или скованность, локализующиеся между нижней парой ребер и ягодичными складками с иррадиацией в нижние конечности или без таковой. Доброкачественная скелетно-мышечная боль в спине не считается нозологической единицей. Высокая распространенность и частое отсутствие конкретной объективно визуализируемой анатомической причины заставили выделить синдром БНС в МКБ-10 в качестве регистрационной, а не нозологической категории М 54.5. Для этой формы БНС не выявлено связи между тяжестью морфологических изменений позвоночника (по данным компьютерной и магнитно-резонансной томографии) и выраженностью боли в спине. Так, явная патология межпозвонковых дисков зачастую обнаруживается у практически здоровых людей, при этом выявление патологических изменений в межпозвонковых дисках не приводит к развитию боли в спине в дальнейшем [2, 3, 5].
С практической точки зрения удобно выделять 3 основные причины болей в спине.
Неспецифическая боль в спине (частота встречаемости — 85–90%). Этот термин означает, что не удалось выявить серьезную патологию (заболевание), явившуюся причиной боли: инфекцию, травму, воспаление, опухоль, остеопороз, ревматоидный артрит, анкилозирующий спондилит, заболевание соединительной ткани и др. Помимо этого, должны отсутствовать специфические признаки вовлечения в процесс корешков спинномозговых нервов (радикулопатия — 1–5%, синдром конского хвоста — до 2%) и стеноза спинномозгового канала.
Специфические причины (частота встречаемости 4–7%):
перелом позвоночника;
первичные и метастатические опухоли позвоночника;
миеломная болезнь;
спондилоартрит;
остеомиелит;
эпидурит;
сирингомиелия;
опухоли спинного мозга и спинномозговых корешков;
заболевания внутренних органов.
Боль, вызванная компрессионной радикулопатией, стенозом поясничного канала (частота встречаемости — 7%).
С учетом того, что большинство заболеваний внутренних органов находятся в сфере ответственности терапевта, становится ясно, что именно этому врачу чаще всего приходится решать проблему болей в спине.
В помощь терапевтам разработаны относительно простые диагностические алгоритмы и опросники [3, 6]. Не требующий специальных инструментов, простой, но скрупулезный диагностический поиск позволяет уже на амбулаторном терапевтическом приеме не только верифицировать самые распространенные причины болевого синдрома, но и заподозрить серьезные заболевания, требующие неотложных мер, диагностических процедур, направления к узким специалистам (табл. 1).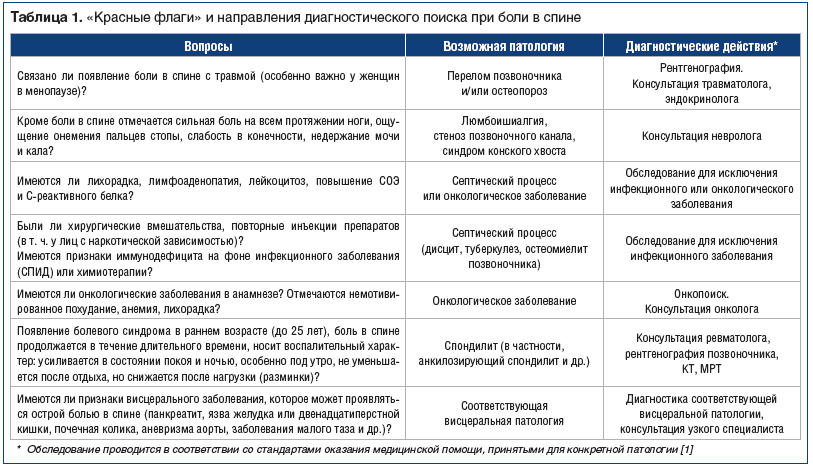
Минимальный лабораторный диагностический набор состоит из анализа крови и мочи, оценки скорости клубочковой фильтрации, концентраций глюкозы и — при возможности — высокоточной оценки С-реактивного белка.
Минимальный инструментально-диагностический набор состоит из измерения артериального давления, ЭКГ, рент-
геновского исследования органов грудной клетки и УЗИ
органов брюшной полости и забрюшинного пространства.
Алгоритм действий врача-терапевта представлен на рисунке 2.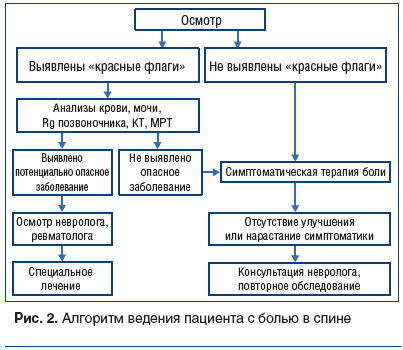
Терапия боли в спине
Сложности в достижении адекватного обезболивания в рутинной практике определяются упомянутой выше коморбидностью, неизбежной полипрагмазией и необходимостью долгосрочной терапии болевого синдрома [7, 8]. У коморбидных пациентов с целой палитрой соматических заболеваний предпочтительным критерием выбора становится безопасность лекарственного препарата и безопасность лекарственного взаимодействия.
Проведенные эпидемиологические исследования показывают, что не более чем у 20% пациентов удается обеспечить адекватное обезболивание. Это связано с использованием недостаточно эффективных либо устаревших лекарств, необоснованных схем применения, рефрактерностью у пациентов, часто использующих анальгетики, нежелательными побочными реакциями и др. [8].
У большинства пациентов проводимая терапия эффективно купирует боли в течение 4 нед. Однако почти у 73% больных в течение первого года наблюдения развивается как минимум одно обострение [7]. Также отмечено, что 20–25% больных продолжают испытывать боль в спине, т. е. страдание становится хроническим, что приводит к существенному возрастанию нагрузки и на органы здравоохранения, и на бюджет в целом: на эту когорту больных тратится до 80% средств здравоохранения [7].
Самым частым средством купирования как острых, так и хронических болевых синдромов в отечественной и мировой практике являются нестероидные противовоспалительные препараты (НПВП). Это корреспондирует и с Рекомендациями по ведению хронической боли [9]. Ключевыми препаратами они остаются и при лечении болей в спине [10]. Выбор НПВП должен быть обдуманным и взвешенным, с оценкой соотношения риска и пользы конкретного препарата.
Чем в основном определяется сегодня безопасность терапии НПВП? Ответ, очевидно, лежит в области коморбидности пациентов, отмечаемой в последнее время не только у пожилых, но и у относительно молодых больных. Так, риск повреждения слизистой оболочки органов желудочно-кишечного тракта (в т. ч. НПВП-гастропатии) есть у большинства пациентов отделений кардиологии, терапии, гастроэнтерологии. Причем кровотечения, связанные с собственно язвенной болезнью, составляют лишь небольшую часть всех желудочно-кишечных кровотечений (ЖКК) в структуре смертельных осложнений, явившихся причиной летального исхода [11]. При безальтернативности применения НПВП при болевых синдромах одной из основных задач менеджмента боли остается выбор правильного препарата и его лекарственной формы [10, 11].
Понимание различной роли изоформ циклооксигеназы (ЦОГ) в механизмах воспаления и генезе побочных эффектов препаратов НПВП привело к разработке и внедрению в широкую клиническую практику наряду с «классическими» и относительно селективных и высокоселективных ЦОГ-2 ингибиторов. Эти препараты имеют лучший профиль гастроэнтерологической безопасности. Однако практика их применения сопровождается сообщениями о кардиоваскулярных рисках высокоселективных ЦОГ-2 ингибиторов. Результаты клинического исследования VIGOR, в котором проводилось сопоставление эффективности и безопасности напроксена и рофекоксиба в симптоматической терапии ревматоидного артрита, показали, что при более низкой частоте желудочно-кишечных побочных эффектов у пациентов, получавших рофекоксиб, частота инфаркта миокарда в этой группе составила 0,4% в сравнении с 0,1% у пациентов группы напроксена [12]. Существенное увеличение риска кардиоваскулярных катастроф при использовании рофекоксиба было получено и в исследовании APPROVe [13]. Поэтому интерес исследователей и клиницистов при применении НПВП при острой и хронической боли смещается к препаратам со сбалансированной активностью в отношении ЦОГ [14]. Особенно это важно для коморбидных пациентов, т. к. сердечно-
сосудистые заболевания и поражения ЖКТ относятся к самым частым вариантам коморбидности.
Представителем НПВП, обладающим благоприятным профилем ингибирования активности ЦОГ, является ибупрофен, считающийся и одним из наиболее изученных анальгетиков в группе НПВП. При лечении сильных болевых синдромов, требующих быстрого купирования, перспективной оказалась комбинация ибупрофена с парацетамолом, обеспечивающая потенцирование действия обоих компонентов, возможность снижения дозировок с минимизацией риска побочных эффектов [15]. Оценка рисков развития желудочно-кишечных осложнений при терапии различными НПВП проведена в исследованиях J. Castellsague et al., А.Е. Каратеева и др., результаты приведены на рисунке 3 [16, 17].
Риски сердечно-сосудистых осложнений при терапии различными НПВП оценены в исследовании С. Varas-Lorenzo et al. (2013), результаты приведены на рисунке 4 [18].
Собственная анальгетическая эффективность предлагаемой комбинации (ибупрофен 200 мг + парацетамол 500 мг, например, препарат Нурофен Лонг) превосходит эффективность монокомпонентных НПВП и даже комбинированных препаратов, содержащих кодеин (рис. 5, 6) [19]. Эта комбинация и в одинарной, и в двойной дозе (ибупрофен 400 мг + парацетамол 1000 мг) имеет самый низкий коэффициент NNT, превосходя по эффективности диклофенак и декскетопрофен [20].
![Рис. 6. Сравнительная эффективность комбинированных анальгетиков [19] Рис. 6. Сравнительная эффективность комбинированных анальгетиков [19]](https://www.rmj.ru/upload/medialibrary/9da/13-7.png)
Двойное слепое плацебо-контролируемое рандомизированное исследование S.E. Daniels et al. (n=600) показало, что комбинация ибупрофен 200 мг + парацетамол 500 мг, содержащаяся в препарате Нурофен Лонг, обеспечивает сопоставимое и даже более эффективное обезболивание, чем комбинированные кодеинсодержащие препараты [19].
Современная технология Synchro-Tech™ позволяет быстро высвобождать компоненты препарата, при этом эффективный обезболивающий эффект развивается уже к 15-й мин, достигает максимума к 40 мин и продолжается до 8 ч. Клинически важным оказывается и наличие противовоспалительного эффекта препарата Нурофен Лонг, реализуемого за счет нескольких механизмов: ингибирования ЦОГ, снижения выработки простагландинов на центральном уровне регуляции, уменьшения выработки провоспалительных медиаторов на локальном уровне, ингибирования миграции лейкоцитов в очаг воспаления.
Терапия болевого синдрома в спине может требовать дополнительного назначения и препаратов, содержащих витамины группы В, миорелаксантов, применения аппаратных методов лечения, физиотерапии, когнитивно-поведенческой терапии, которую ряд исследователей относит к первостепенным подходам. При всей обоснованности этих рекомендаций именно успешность (скорость и мощность) обезболивания определяет впечатление пациента от назначений врача, формирует уровень доверия и повышает комплаентность, что в конечном итоге служит залогом эффективности терапии.
Заключение
Лечением болевых синдромов в спине занимаются врачи разных специальностей, однако в первую очередь такие пациенты обращаются на амбулаторный прием к врачутерапевту. Этот синдром требует вдумчивой диагностики и терпеливого подхода к терапии с использованием современных лекарственных средств и немедикаментозных подходов.
Источник

Диагностика боли в спине
Хотелось бы подчеркнуть, что причины боли в спине могут быть самые разные, боль в спине нередко служит сигналом серьезных заболеваний внутренних органов, поэтому при появлении острой боли в спине следует избегать самолечения и для установления правильного диагноза необходимо произвести ряд исследований (табл. 45).
Таблица 45. Исследования для диагностики болевого синдрома в спине
Причина болевого синдрома | Исследования |
Нерадикулярная боль: – отсутствие в анамнезе травмы или факторов риска – подозрение на скрытую инфекцию или неопластический процесс – спондилолистез, не поддающийся консервативному лечению или сопровождающийся выраженной неврологической симптоматикой | Рентгенография в передне-задней и боковой проекциях. Остеосцинтиграфия, МРТ Рентгенография в положениях сгибания-разгибания, КТ, МРТ, остеосцинтиграфия |
Радикулярная боль: – персистирующие симптомы ишиальгии с очевидным поражением нервного корешка – ишиальгия с неопределенным уровнем поражения нервного корешка | МРТ ЭМГ, КТ, МРТ |
Травма: – поражение двигательного нервного ствола при минимальной травме у пациента с возможными структурными изменениями костной ткани | Рентгенография после установления механизма травмы |
Подозрение на остеомиелит – над позвонком определяется точка, болезненная при пальпации | МРТ |
Неопластические процессы в анамнезе, клинические проявления согласуются с метастатическими поражениями | Остеосцинтиграфия, МРТ |
Поставить правильный диагноз помогают дополнительные анализы (табл. 46) и дифференциальная диагностика (табл. 47,48).
Таблица 46. Значение лабораторных исследований в дифференциальной диагностике болей в спине
Отклонения | Возможные заболевания |
Повышение СОЭ | Спондилоартриты, ревматическая полимиалгия, злокачественные опухоли, туберкулез, остеомиелит, абсцесс |
Повышение активности щелочной фосфатазы | Метастазы в кости, болезнь Педжета, остеомаляция, первичный гиперпаратиреоз |
Патологический пик на электрофореграмме белков сыворотки | Миеломная болезнь |
Положительный посев крови | Сепсис с развитием остеомиелита или абсцесса |
Выявление простатического специфического антигена | Рак предстательной железы |
Выявление HLA-B27 | Спондилоартриты |
Изменения в анализах мочи | Заболевания почек (камни, опухоль, пиелонефрит), болезнь Рейтера |
Положительные туберкулиновые пробы | Туберкулез костей или спинного мозга |
Таблица 47. Дифференциальная диагностики болей в спине
Группы причин | ||||
Признаки | механические | воспалительные | мягкотканные | очагово-инфиль-тративные |
Начало | Вариабельно, часто острое | Подострое | Подострое | Постепенное |
Локализация | Диффузная | Диффузная | Диффузная | Очаговая |
Симметричность процесса | Односторонний | Чаще двусторонний | Генерализованный | Односторонний или по средней линии |
Интенсивность | Вариабельна | Умеренная | Умеренная | Выраженная |
Неврологическая симптоматика | Характерна | Нет | Нет | Обычно нет |
Утренняя скованность | До 30 мин | Более 30 мин | Вариабельна | Нет |
Реакция боли на покой | Ослабление | Усиление | Вариабельна | Нет (боль постоянна) |
Реакция боли на физактивность | Усиление | Ослабление | Вариабельна | Нет (боль постоянна) |
Боль в ночное время | Слабая, зависит от положения | Умеренная | Умеренная | Сильная |
Системные проявления | Нет | Характерны | Нет | Возможны |
Возможные заболевания | Остеохондроз, грыжа/ повреждение диска, перелом позвонка, спондилолистез | Спондило-артрит, ревматическая полимиалгия | Фибромиалгия, миофасциальный синдром, перенапряжение мышечно-связочного аппарата | Опухоль, инфекционное поражение костей или мягких тканей |
В диагностике боли в спине могут также помочь приведенные ниже алгоритмы №1-5.

Алгоритм диагностики боли в спине №1

Алгоритм диагностики боли в спине №2

Алгоритм диагностики боли в спине №3

Алгоритм диагностики боли в спине №4

Алгоритм диагностики боли в спине №5
Г.И. Лысенко, В.И. Ткаченко
Источник
Высокая распространенность в популяции боли в спине определяет медицинскую и социальную значимость данной проблемы. Боль в спине снижает активность, трудоспособность, ухудшает психоэмоциональное состояние, в отдельных случаях является угрозой для жизни. Согласно статистическим данным, у 15–20% пациентов с острой болью в спине велика вероятность ее хронизации. Это объясняется разными причинами: несвоевременным обращением за медицинской помощью, низким уровнем комплаентности, в отдельных случаях – ошибочными или неадекватными действиями врача. Сложный механизм развития боли в спине, бездоказательное установление причинно-следственной связи между полученными результатами дополнительных методов обследования и клиническими данными, использование традиционных схем лечения независимо от типа боли, недооценка коморбидной патологии затрудняют диагностику и лечение. Все это определяет актуальность проблемы боли в спине в целом и оптимизации диагностических и терапевтических подходов в частности [1–3].
Диагностика
На первом визите на основании детального сбора жалоб, анамнеза, неврологического и, при необходимости, соматического осмотра необходимо определить у пациентов тип боли по этиологии: специфическая, скелетно-мышечная неспецифическая и корешковая.
Причинами специфической боли могут быть заболевание внутренних органов или сосудов (аневризма брюшной аорты), ревматический, воспалительный или инфекционный процесс, первичная или метастатическая опухоль, метаболические нарушения и др. На высокую вероятность данного типа боли указывают симптомы «опасности» («красные флажки»): повышение температуры, травма в анамнезе, изменение веса тела за последний год, утренняя скованность, интенсивная ночная локальная боль, тазовые нарушения. При наличии одного из этих симптомов рекомендуется проводить неврологический и общесоматический осмотр, при необходимости – дополнительные лабораторные и диагностические обследования с привлечением узких специалистов.
После исключения специфической боли рекомендуется проводить дифференциальную диагностику неспецифической и корешковой боли в спине.
Неспецифическая скелетно-мышечная боль обусловлена механическим воздействием на связки, мышцы, сухожилия и фасции (мышечно-тонический или миофасциальный синдром), межпозвонковые диски, фасеточные суставы позвоночника (фасеточный синдром). Корешковая боль развивается в результате компрессии спинномозгового корешка или спинномозговых нервов [1–3]. Для проведения дифференциальной диагностики рекомендуется придерживаться следующего алгоритма обследования.
1. Оценить положение больного, осанку, позу, походку, объем движения.
При болевом синдроме возможно формирование анталгической позы, которая уменьшает интенсивность боли, разгружает компримированный корешок. Анталгические позы бывают самыми разными вследствие уплощения лордоза, увеличения кифоза или формирования сколиотической установки. Анталгическая поза меняет походку – больной может сгибать ногу в суставах, прихрамывать и т. п. Для определения объема движений мы рекомендуем использовать функциональные тесты Минора, Петелина, Попелянского, Отта, Шобера.
2. Определить интенсивность, локализацию и характер боли.
Наиболее чувствительным методом для количественной оценки боли является визуальная аналоговая шкала (ВАШ). Дополнительно используют вербальную шкалу (ВШ). Боль может быть локальной или диффузной с иррадиацией. Мышечно-тонический синдром при неспецифической боли – локальный. При миофасциальном синдроме боль может быть локальной или иррадиировать, но не по корешковому типу. Корешковая боль иррадиирует по ходу нерва. По классификации, предложенной Международной ассоциацией по изучению боли (IAPS, 1994), острая боль продолжается до 12 нед., хроническая – свыше 12 нед. Некоторые авторы выделяют период подострой боли – от 6 до 12 нед. [1–3].
3. Оценить мышечную силу и мышечный тонус.
Мышечная сила оценивается по 5-балльной шкале. Мышечный тонус определяется при пальпации, выделяют 3 степени напряжения мышц. Для мышечно-тонического синдрома характерны боль и повышение мышечного тонуса, который ограничивает объем движения в соответствующем двигательном сегменте. Мышечный тонус может быть локализован во всей мышце, отдельном ее участке или в нескольких мышцах. Боль уменьшается в покое и усиливается при движении. Для миофасциального синдрома характерны боль и наличие в одной или нескольких мышцах триггерных точек, которые представляют собой гипервозбудимую область, болезненную при пальпации. При корешковой боли возможны снижение мышечной силы и повышение мышечного тонуса. Мышечный спазм уменьшает подвижность нервных корешков, снижает их способность к растяжению. Проверяются следующие симптомы натяжения: Ласега, посадки, Бонне, Вассермана – Мацкевича, Нери, Дежерина.
4. Выявить сопутствующие симптомы.
Могут наблюдаться нарушения чувствительности: гиперестезия – повышение чувствительности; гиперпатия – извращенная чувствительность, отсутствует чувство локализации и отмечается неприятный оттенок ощущений; дизестезия – извращение чувствительности, при котором одно раздражение воспринимается как другое; парестезии – неприятные ощущения, возникающие без нанесения раздражений; анестезия – полная утрата того или иного вида чувствительности; сенестопатии (жжение, неприятные ощущения с психоэмоциональными наслоениями). При корешковой боли (при поражении заднего корешка) возможно нарушение всех видов чувствительности в соответствующем дерматоме. При неспецифической боли также могут быть нарушения чувствительности и сенестопатии.
5. Проверить сухожильные и периостальные рефлексы.
Исследование сухожильных и периостальных рефлексов важно для установления уровня поражения корешка или спинного мозга. Чаще отмечают понижение или выпадение рефлексов, но может быть гиперрефлексия, что указывает на симптомы раздражения определенных образований. При корешковом синдроме отмечается комплекс симптомов: боль, расстройство чувствительности, нарушение движения с развитием мышечной слабости вплоть до плегии, изменение тонуса и трофики мышц, снижение или полное отсутствие сухожильных рефлексов [1–3].
Далее для уточнения состояния позвоночника рекомендуется функциональная рентгенография с целью определения расположения позвонков, наличия аномалий и выраженности дегенеративно-дистрофического процесса. Необходимо учитывать, что нет четкой корреляции между выявленными изменениями и клинической картиной. При корешковом синдроме информативно нейровизуализационное исследование – магнитно-резонансная томография позвоночника (МРТ). МРТ отличается безвредностью и возможностью получить изображения с большой точностью, увидеть срезы позвоночного столба и спинного мозга, размеры и расположение грыжи. Алгоритм диагностики представлен на рисунке 1.
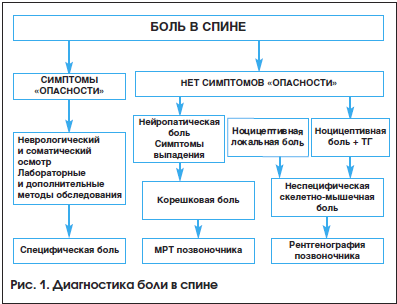
Лечение
В остром периоде важной задачей является купирование боли. Для этого назначаются нестероидные противовоспалительные препараты (НПВП). Они ингибируют циклооксигеназу (ЦОГ) – основной фермент метаболизма арахидоновой кислоты, оказывают противовоспалительное и обезболивающее действие. ЦОГ присутствует в организме в двух изоформах: ЦОГ-1 и -2. ЦОГ-1 находится во всех тканях и регулирует ряд физиологических функций. ЦОГ-2 синтезируется на фоне воспаления. По отношению к ЦОГ все НПВП разделяют на неселективные, или традиционные, селективные и высокоселективные. Неселективные НПВП ингибируют ЦОГ-1 и -2. Эта группа блокирует выработку простагландинов не только в очаге воспаления, но и в здоровых органах и клетках крови. В результате кроме положительного эффекта появляются побочные симптомы. Поскольку простагландины защищают слизистую желудка от агрессивного воздействия кислого желудочного сока, то при назначении традиционных НПВП высока вероятность развития гастропатий, повышен риск кровотечений. Возможны и другие побочные симптомы: снижение диуреза, тенденция к бронхоспазму, головокружение, повышение артериального давления.
Селективные НПВП ингибируют преимущественно ЦОГ-2, поэтому имеют улучшенный профиль безопасности. Производные оксикамов (мелоксикам) имеют ряд преимуществ по сравнению с другими селективными НПВП, не являются гепатотоксичными и не вызывают осложнений со стороны сердечно-сосудистой системы [4]. Мелоксикам имеет большой период полувыведения, максимальная концентрация (Cmax) в плазме после приема 15 мг препарата достигается через 7 ч, время полувыведения составляет 20–24 ч. Это позволяет назначать его 1 р./сут, что значительно повышает комплаентность пациентов. Мелоксикам обладает длительным обезболивающим эффектом. Он не оказывает ингибирующего действия на образование протеогликана и не увеличивает синтез интерлейкина-1, поэтому не влияет негативно на хрящ и считается хондронейтральным препаратом.
С целью оптимизации результатов лечения, усиления анальгезирующего действия рекомендуется в схему терапии включать витамины группы В. Они имеют сложный механизм действия. Витамин В1 (тиамин) улучшает проведение нервного импульса, обладает антиоксидантной активностью, играет роль коэнзима в цикле Кребса – основном цикле утилизации глюкозы с образованием энергии. Самостоятельно или в комбинации с витаминами В6 и В12 способен тормозить прохождение болевой импульсации на уровне задних рогов и таламуса, уменьшает интенсивность боли, парестезий, улучшает температурную и вибрационную чувствительность. Тиамин – это водорастворимая форма В1, она всасывается за счет активного транспорта, легко разрушается тиаминазой, поэтому не накапливается в организме. Жирорастворимая форма тиамина (бенфотиамин) эффективнее водорастворимой. Бенфотиамин всасывается за счет пассивной диффузии и обладает в 120 раз большей внутриклеточной биодоступностью, чем тиамин.
Витамин B6 (пиридоксин) является коферментом в метаболизме аминокислот, регулирует обмен нейромедиаторов норадреналина, дофамина и миелиновой ткани, участвует в синтезе транспортных белков и гамма-аминомасляной кислоты, которая является важнейшим тормозным нейромедиатором ЦНС человека. Витамин B6 оказывает влияние на трофические процессы в нервной ткани, создает условия для более успешной регенерации нервных волокон. Снижает болевые ощущения, связанные с поражением периферической нервной системы.
Витамин В12 (цианокобаламин) в организме метаболизируется в метилкобаламин, который образуется в результате распада гомоцистеина. После активизации реакции трансметилирования из метионина синтезируется промежуточный продукт – S-аденозил-метионин, затем из него – фосфатидилхолин. Фосфатидилхолин – одна из самых распространенных молекул, входящих в состав клеточных мембран. Таким образом, витамин В12 является необходимым веществом, стимулирующим процессы регенерации. Витамин В12 участвует в синтезе ДНК всех делящихся клеток, необходим для синтеза миелина, который входит в состав миелиновой оболочки аксонов ряда нейронов. Миелиновая оболочка выполняет не только защитные функции, но и ускоряет передачу нервных импульсов. Витамин В12 оказывает обезболивающее действие. Доказано, что терапия витаминами В1, В6 и В12 более эффективна, чем монотерапия одним из этих витаминов.
В комплексную терапию боли в спине при мышечном напряжении включают миорелаксанты. При боли на фоне дегенеративно-дистрофического процесса назначаются с первого дня обострения структурно-модифицирующие медленнодействующие препараты. При корешковой невропатический боли рекомендуются антиконвульсанты, среди которых хорошо себя зарекомендовал габапентин. Препарат имеет сложный механизм действия. Он оказывает модулирующее влияние на NMDA-рецепторы, блокирует α2δ-субъединицу кальциевых каналов, снижает высвобождение моноаминов, уменьшает синтез и транспорт глутамата, блокирует потенциалзависимые N-кальциевые каналы, что приводит к снижению боли, аллодинии и механической гиперсенситивности. Габапентин обладает высокой терапевтической эффективностью. При постепенном подборе оптимальной дозы методом титрации хорошо переносится, побочные явления не выражены [5].
При остром болевом синдроме развитие воспалительной реакции приводит к высвобождению провоспалительных цитокинов, местным расстройствам гемодинамики и лимфодинамики, повышению сосудистой проницаемости и, как следствие, – накоплению жидкости в межклеточном пространстве. Отек может вызвать метаболические нарушения, вторичное расстройство кровообращения, местную гипоксию тканей вплоть до некроза [6, 7]. Выраженным и быстрым противоотечным действием обладает препарат L-лизина эсцинат. Он состоит из аминокислоты L–лизина и тритерпеновых сапонинов конского каштана. L–лизина эсцинат оказывает анальгетическое и антиэкссудативное действие посредством нормализации повышенной сосудистой проницаемости. Ингибирование активности аутолитических ферментов предупреждает расщепление мукополисахаридов в стенках капилляров и в соединительной ткани, которая их окружает. Проявляя антагонизм в отношении брадикинина и серотонина, препарат нормализует капиллярную проницаемость, улучшает микроциркуляцию и лимфоотток, уменьшает выраженность экссудативного и воспалительного процесса [8, 9]. L-лизина эсцинат вводят строго в/в медленно капельно в суточной дозе 5 мл, предварительно разведя в 50–100 мл 0,9% раствора натрия хлорида. Длительность лечения – 5–10 дней в зависимости от динамики терапевтического эффекта.
L-лизина эсцинат также показал свою эффективность в лечении хронического болевого синдрома у пациентов с грыжами одного или нескольких поясничных межпозвонковых дисков (сопровождающихся расширением корешковых вен конского хвоста, эпидуральных вен, центральных вен тела позвонка). Применение препарата способствовало р
